Niezwykłe bariery
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (3/2017):

O błonach półprzepuszczalnych i osmozie
Pojęcie komórki sformułował jako pierwszy w 1665 roku Robert Hooke. Terminem tym określamy w biologii najmniejszą funkcjonalną i strukturalną jednostkę organizmu żywego, która może prowadzić wszystkie podstawowe procesy życiowe. Komórka musi więc być zdolna do przemiany materii, a także wzrostu i rozmnażania w odpowiedni dla siebie sposób. Można więc powiedzieć, że jest ona podstawową jednostką morfologiczno−czynnościową ustroju [1]. Wiemy, że komórki wykazują między sobą duże różnice morfologiczne i biochemiczne. Różnice te są na tyle duże, że niektóre z nich stanowią samodzielne organizmy jednokomórkowe, zaś inne są elementami składowymi organizmów wielokomórkowych.
Komórka jest otoczona błoną komórkową. Występowanie wewnątrz niej jądra komórkowego jest podstawą podziału organizmów na jądrowe (eukarionty, łac. Eucaryota) i bezjądrowe (prokarionty, łac. Procaryota). U większości prokariontów, roślin, grzybów i niektórych innych grup organizmów na zewnątrz błony komórkowej występuje dodatkowo charakterystyczna struktura o złożonej i zróżnicowanej budowie – ściana komórkowa. Jest to struktura martwa, nie wykazująca własnego metabolizmu. Wewnątrz komórki znajduje się cytoplazma, a u eukariontów także szereg wewnętrznych organelli pełniących określone funkcje, np. mitochondria, plastydy, aparat Golgiego, wakuole i inne.
Błona komórkowa nazywana też błoną cytoplazmatyczną lub plazmolemmą jest zbudowana z dwóch warstw fosfolipidów oraz białek, z których część jest luźno związana z powierzchnią błony (białka powierzchniowe), a inne przebijają błonę (białka transbłonowe) lub są w niej w jakiś sposób zakotwiczone (białka błonowe).
Zauważmy, że błona komórkowa pełni bardzo ważną funkcję – oddziela środowisko zewnętrzne od wnętrza komórki. Roli tej nie w sposób przecenić, gdy tylko uświadomimy sobie, że życie przynajmniej na poziomie molekularnym jest złożonym zespołem ściśle sprzężonych procesów fizyko-chemicznych i jako takie wymaga do ich prowadzenia odpowiednich warunków, m.in. właśnie oddzielenia ich od uorganizowanego w inny sposób środowiska zewnętrznego.
Błona komórkowa jako bariera nie może być jednak całkowicie nieprzepuszczalna, ponieważ żadna komórka nie mogłaby żyć jako układ izolowany, tj. bez możliwości wymiany materii i energii z otoczeniem.
Tak więc błona komórkowa z jednej strony musi stanowić barierę oddzielającą wnętrze komórki od środowiska zewnętrznego, a jednocześnie umożliwiać transport pewnych substancji w obie strony. Tego typu barierę nazywamy błoną (membraną) półprzepuszczalną. Oczywiście półprzepuszczalność jest tylko jedną z cech błony komórkowej, ponieważ ma ona dużo bardziej skomplikowaną budowę niż to tutaj pokrótce nakreślono.
Błony półprzepuszczalne wykazują szereg bardzo interesujących właściwości, z którymi możemy się zapoznać. W dalszej części artykułu chciałbym zaproponować Czytelnikowi przeprowadzenie kilku niezbyt skomplikowanych, a jednocześnie ciekawych doświadczeń, w których wykorzystano zarówno naturalne, jak i sztuczne błony półprzepuszczalne.
O osmozie – nieco teorii
Możemy powiedzieć, że błona półprzepuszczalna to taka bariera, która przepuszcza niektóre rodzaje cząsteczek, a zatrzymuje inne. Mogą przez nią przenikać np. niewielkie cząsteczki rozpuszczalnika, blokowane są natomiast duże cząsteczki substancji rozpuszczonej lub jony [2].
Aby zrozumieć procesy zachodzące w przypadku błony półprzepuszczalnej musimy przypomnieć sobie o dyfuzji. Jest to proces samorzutnego rozprzestrzeniania się cząsteczek lub energii w każdym ośrodku (ciele stałym, gazie lub cieczy) o temperaturze wyższej od zera absolutnego - jest to efekt chaotycznych zderzeń cząsteczek substancji dyfundującej między sobą lub z cząsteczkami ośrodka.
Zastanówmy się jednak, co się stanie w przypadku, kiedy za pomocą błony półprzepuszczalnej rozdzielimy dwa roztwory o różnym stężeniu. Obrazuje to schematycznie Rys.1. Zauważmy, że w prawej części naczynia stężenie substancji rozpuszczonej jest dużo większe niż w lewej. Przez zaznaczoną w postaci szarej przegrody błonę półprzepuszczalną mogą przenikać jedynie niebieskie cząsteczki rozpuszczalnika, natomiast dużo większe czerwone cząstki substancji rozpuszczonej nie mają takiej możliwości.
W takim przypadku cząsteczki rozpuszczalnika mają częstszy kontakt z błoną po stronie o niższym stężeniu, ponieważ przy wyższym w roztworze istnieje większa ilość cząsteczek substancji rozpuszczonej, z którymi cząsteczki rozpuszczalnika niejako konkurują o dostęp do błony. W efekcie więcej cząsteczek rozpuszczalnika przenika przez błonę w kierunku od roztworu mniej stężonego do bardziej stężonego, niż odwrotnie. Możemy więc zaobserwować przenikanie rozpuszczalnika właśnie w tym kierunku. Zjawisko to nazywamy osmozą. Zauważmy, że w wyniku osmozy dochodzi do powolnego wyrównywania się stężeń roztworów po obu stronach błony półprzepuszczalnej: roztwór o niższym stężeniu ulega zatężeniu poprzez odpływ rozpuszczalnika, zaś bardziej stężony ulega rozcieńczeniu przez dopływ rozpuszczalnika.
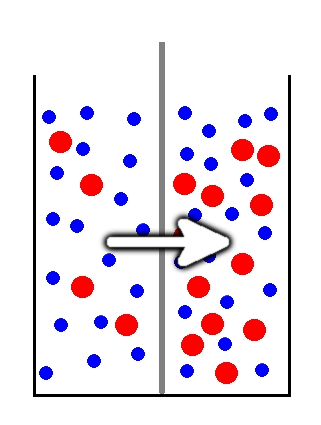
Roztwór o niższym stężeniu, tj. ten z którego ubywa rozpuszczalnika nazywa się hipotonicznym, natomiast ten o wyższym stężeniu, w którym przybywa rozpuszczalnika nazywa się hipertonicznym. Gdy roztwory pozostają w równowadze osmotycznej (tzn. wymiana rozpuszczalnika zachodzi w tym samym tempie w obu kierunkach), mówi się że są wzajemnie izotoniczne.
W jaki sposób to zbadać?
Istnieje wiele sposobów na zapoznanie się ze zjawiskiem osmozy w układach biologicznych. Niezależnie od tego, który z nich wybierzemy jest nam jednak potrzebna jakaś błona półprzepuszczalna.
Dla adepta biologii zdobycie odpowiedniego materiału nie stanowi jednak problemu. W pierwszym doświadczeniu proponuję wykorzystanie zwierzęcej błony półprzepuszczalnej w postaci jelit zwierzęcych (Fot.1).
Są to fragmenty oczyszczonego jelita cienkiego pochodzącego od świni. Zdobycie materiału nie jest trudne – jelita takie stanowią surowiec do wyrobu kiełbas i można je kupić w odpowiednich sklepach. Zaznaczam jednak, że niektóre z nich, szczególnie te paczkowane o długich okresach trwałości nie nadają się, ponieważ proces konserwacji uszkadza jelita i tracą one funkcję błony półprzepuszczalnej. Przed wykorzystaniem warto namoczyć jelita w przegotowanej wodzie o temperaturze około 30°C, tak by nabrały odpowiedniej elastyczności.
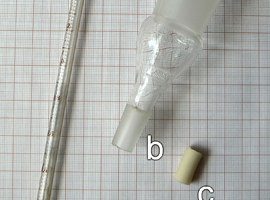
Następnie trzeba zbudować odpowiedni układ doświadczalny – został on przedstawiony na Rys.2. Składa się on z lejkowatego naczynia wypełnionego roztworem a. Jest ono z jednej strony zamknięte błoną półprzepuszczalną i zanurzone w roztworze b o stężeniu innym niż wewnątrz lejka, zaś z drugiej strony zakończone cienką rurką c otwartą ku górze.
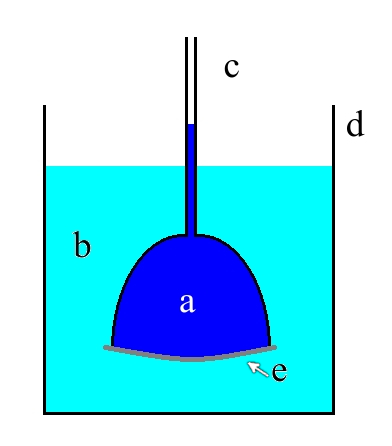
Układ taki można zbudować ze stosunkowo łatwo dostępnych elementów, np. takich jak na Fot.2. W roli lejka znakomicie sprawdzi się szklany reduktor szlifu wykorzystywany w sprzęcie laboratoryjnym. Jego węższe ujście należy połączyć za pomocą odcinka gumowej rurki z wylewem pipety miarowej o niewielkiej pojemności, np. 2cm3. Zaletą takiego rozwiązania jest ułatwiona możliwość odczytywania poziomu cieczy na tle skali pipety.
Szersze zakończenie reduktora zgodnie ze schematem powinno zostać zamknięte błoną półprzepuszczalną. Można ją przygotować poprzez rozcięcie fragmentu świńskiego jelita wzdłuż i rozprostowanie tak uzyskanej membrany (Fot.3).
Błonę trzeba umocować w sposób zapewniający jak najlepszą szczelność na styku ze szkłem. Wygodnie jest w tym celu użyć kilka gumek recepturek (Fot.4).
Z błoną uzyskaną z jelita należy obchodzić się dosyć ostrożnie, ponieważ chociaż jest ona dosyć wytrzymała na rozciąganie, to z łatwością można ją przekłuć, co oczywiście uniemożliwi przeprowadzenie doświadczenia. Trzeba także uważać, aby jej nie przesuszyć. Błona powinna być ciągle wilgotna.
W naszym przypadku jako roztwór hipotoniczny radzę zastosować wodę destylowaną, zaś jako hipertoniczny stężony w temperaturze pokojowej roztwór glukozy – dla ułatwienia obserwacji roztwór ten można zabarwić barwnikiem spożywczym (Fot.5).
Gotowy, zestawiony w całości układ przedstawia Fot.6. Do zawieszenia całości w naczyniu z wodą destylowaną posłużyła łapa do probówek osadzona w statywie laboratoryjnym.
Bezpośrednio po zestawieniu układu należy odczytać początkową wysokość słupa cieczy (Fot.7A). Pozostawiając układ w spokoju po pewnym czasie można zauważyć, że wysokość słupa cieczy rośnie (Fot.7B). Gdybyśmy nie wiedzieli o zjawisku osmozy mogłoby wydać się nam to dosyć zaskakujące, ponieważ dzieje się to najwyraźniej przeciwko sile grawitacji. Po chwili zastanowienia możemy jednak stwierdzić, że zgadza się to całkowicie z naszymi teoretycznymi rozważaniami na temat osmozy, ponieważ to właśnie dzięki niej zachodzi transport rozpuszczalnika od zewnętrznego roztworu hipotonicznego do wewnętrznego hipertonicznego, co obserwujemy jako wzrost wysokości słupa cieczy.
Potwierdza to także drugie doświadczenie, gdzie roztwór hipertoniczny znajduje się na zewnątrz, zaś hipotoniczny wewnątrz lejka. W tym przypadku zabarwiono oczywiście roztwór hipotoniczny, a początkowa wysokość słupa cieczy była taka sama jak w poprzednim doświadczeniu. Tym razem po pewnym czasie poziom słupa wody ulega wyraźnemu obniżeniu (Fot.7C).
Przy wykorzystaniu opisanego układu doświadczalnego można badać także właściwości innych błon półprzepuszczalnych.
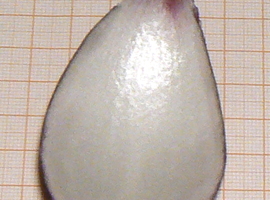
O istnieniu osmozy możemy się też przekonać przy wykorzystaniu ziemniaka. W tym celu należy wykroić z surowej bulwy ziemniaka dwa niewielkie fragmenty np. w kształcie prostopadłościanu (Fot.8).
Obie ziemniaczane kostki należy zważyć i zanotować wyniki, a następnie jedną z nich zanurzyć w roztworze hipotonicznym (woda destylowana), a drugą w roztworze hipertonicznym (stężony roztwór glukozy) w stosunku do wnętrza komórek, z których jest zbudowana bulwa. Po pewnym czasie (zwykle wystarczą już trzy godziny) należy wyjąć kostki z roztworów, delikatnie je osuszyć papierowym ręcznikiem lub bibułą filtracyjną, a następnie ponownie zważyć. Wyniki uzyskane w efekcie przeprowadzonego przeze mnie doświadczenia ilustruje Tab.1.
| R-r hipotoniczny | R-r hipertoniczny | |
|---|---|---|
| Masa kostki - początkowa [g] | 3,23 | 3,00 |
| Masa kostki - końcowa [g] | 3,76 | 2,48 |
| Zmiana masy [g] | +0,53 | -0,52 |
| Zmiana masy [%] | +16,4% | -17,3% |
W obu przypadkach masa kostki wyciętej z bulwy ziemniaka uległa zmianie. W przypadku kostki zanurzonej w roztworze hipotonicznym masa wzrosła o 0,53g, zaś w odniesieniu do kostki zanurzonej w roztworze hipertonicznym masa zmalała o 0,52g (odpowiednio +16,4% i -17,3%). Tak więc zmiana co do wartości bezwzględnej była bardzo podobna w obu przypadkach.
Możemy stwierdzić, że zmiana masy próbek została spowodowana przez osmozę. W wyniku tego zjawiska, w zależności od stężenia środowiska zewnętrznego woda wnikała lub wypływała z komórek ziemniaka – rolę błony półprzepuszczalnej pełniła tu m.in. ich błona komórkowa. Zmiana zawartości wody była na tyle duża, że ujawnił ją pomiar masy kostek. Potwierdza to także wygląd kostek po wyłowieniu ich z roztworu – jedna z nich dosyć wyraźnie zmniejszyła swoje wymiary, a także stała się miękka (Fot.9a), natomiast druga zachowała jędrność (Fot.9b).
Ważnym przejawem osmozy jest istnienie zjawiska plazmolizy. Można je stwierdzić w przypadku wielu komórek roślinnych. Wygodnie jest zastosować liście spichrzowe cebuli zwyczajnej Allium cepa. Wewnętrzna skórka tych liści jest zbudowana z cienkiej warstwy komórek, które można łatwo obserwować w mikroskopie świetlnym przy wykorzystaniu niezbyt dużych powiększeń. Polecam zastosowanie czerwonej odmiany cebuli, ponieważ zawartość barwnika w komórkach zwiększy kontrast obrazu bez stosowania sztucznych środków barwiących - ułatwi to obserwacje.
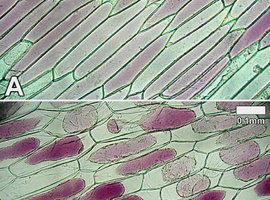
Skórkę łatwo oddzielić od liścia za pomocą pęsety – najlepiej pobrać ją z górnej części wewnętrznej strony liścia, tam gdzie tkanka jest silniej wybarwiona, a jednocześnie w dalszym ciągu przejrzysta (Fot.10). Następnie należy umieścić ją w kropli wody destylowanej i wykroić z niej niewielki fragment. Fragment ten trzeba umiejscowić na szkiełku podstawowym w kolejnej kropli wody destylowanej i po przykryciu szkiełkiem nakrywkowym obserwować, dobierając odpowiednio wartość powiększenia. Można wtedy zaobserwować normalny obraz, tj. wielokątne, wydłużone komórki skórki (wyraźnie widoczne są ściany komórkowe), wypełnione w większości przez duże wakuole. Cytoplazma jest słabo widoczna i stanowi jedynie cienką warstwę wokół wakuol, jądra komórkowe są także trudne do dostrzeżenia (Fot.11A). Widoczne jest zabarwienie w obrębie protoplastu.
Następnie trzeba przygotować kolejny preparat, z tą jednak różnicą, że pobrana skórka powinna być przez kilka, kilkanaście minut przed obserwacją przechowywana w stężonym roztworze glukozy. Do obserwacji fragment skórki także powinien zostać zamknięty pod szkiełkiem nakrywkowym w kropli tego samego roztworu. Obraz jaki można wtedy zaobserwować przedstawia Fot.11B. Na skutek osmozy część wody przemieściła się z wnętrza komórek do otaczającego je roztworu. W wyniku odwodnienia protoplasty zmniejszają swoją objętość i zaczynają odstawać od ścian komórkowych. Właśnie ten proces nazywamy plazmolizą [3]. Jeśli tylko w czasie plazmolizy nie zostanie uszkodzona błona komórkowa, to poprzez umieszczenie komórek w roztworze hipotonicznym można wywołać zjawisko odwrotne, czyli deplazmolizę.
Błony półprzepuszczalne raz jeszcze – tym razem nieorganiczne
Do tej pory zajmowaliśmy się jedynie organicznymi błonami półprzepuszczalnymi. Ale można je wytworzyć także w całkowicie sztuczny sposób. Przykładem może być tu np. celofan – przejrzysta folia celulozowa [4].
W oparciu o zjawisko osmozy można wykonać też bardzo ciekawe doświadczenia nazywane często chemicznym ogrodem lub chemicznymi roślinami. W wyniku reakcji rozpuszczalnych krzemianów z solami metali ciężkich (Fot.12A) lub rozpuszczalnych heksacyjanożelazianów(II) z solami dwuwartościowej miedzi (Fot.12B) dochodzi do powstania błon półprzepuszczalnych zbudowanych z nierozpuszczalnych produktów. Woda wnikając do tak powstałych pęcherzyków na drodze osmozy prowadzi do ich rozdęcia oraz pękania, co daje efekt w postaci rosnących z zauważalną prędkością, często rozgałęziających się tworów przypominających fantastyczne rośliny i inne twory biologiczne [5] [6]. Uzyskany obraz warto docenić nie tylko ze względów estetycznych, ale także powodu wysokiej wartości dydaktycznej tego doświadczenia.
Podsumowanie
Opisane doświadczenia są nieskomplikowane i z łatwością można je powtórzyć w warunkach szkolnych lub domowych. Ważne jest, że pomagają przy tym w zaznajomieniu się z bardzo ciekawym, a jednocześnie ważnym zjawiskiem osmozy, które łączy dziedziny biologii, chemii i fizyki.
Dodatkowo osmoza i same membrany półprzepuszczalne znajdują wiele zastosowań w dzisiejszym świecie. Dializa krwi osób z chorobami nerek, odsalanie wody morskiej, oczyszczanie wody dzięki odwrotnej osmozie to tylko niektóre z nich. Myślę więc, że ten temat jak najbardziej zasługuje na uwzględnienie w dydaktyce dziedzin przyrodniczych.
Literatura:
- [1] Sawicki W., Histologia, Wydawnictwo Lekarskie PZWL, Warszawa, 2008 powrót
- [2] Rautenbach R., Procesy membranowe, Wydawnictwo Naukowo-Techniczne, Warszawa, 1996 powrót
- [3] Guzik M., Kozik R., Jastrzębska E., Matuszewska R., Pyłka-Gutowska E., Zamachowski W., Biologia na czasie 1, Wydawnictwo Nowa Era, 2013, str. 61 powrót
- [4] Hassa R. (red.), Mrzigod J. (red.), Nowakowski J. (red.), Podręczny słownik chemiczny, Wydawnictwo Videograf II, Katowice, 2004, str. 66 powrót
- [5] Ples M., Chemiczne rośliny, Chemia w Szkole, 5 (2015), Agencja AS Józef Szewczyk, str. 6-9 powrót
- [6] Ples M., Chemiczny ogród, w serwisie: www.weirdscience.eu, dostępne online: http://weirdscience.eu/Chemiczny%20ogr%C3%B3d.html [dostęp: 10.04.2017] powrót
Wszystkie fotografie i rysunki zostały wykonane przez Autora.
Marek Ples